AI/MN POR REDUCCIÓN
ALUMINOTÉRMICA DEL MN2 O3
* A. Flores Valdés, ** R. Juárez Martínez, ** J. Velázquez Rodríguez
* Centro de Investigación y de Estudios Avanzados del IPN, Unidad Saltillo
** Fundición JV S.A. de C.V.
INTRODUCCIÓN
El reciclado de aluminio reduce la contaminación un 90%, y contribuye a un menor uso de la electricidad, en comparación con el procesamiento de aluminio primario. Las aleaciones de la serie Al-Mn-Mg se han utilizado como materia prima para la elaboración de latas de bebidas, en estas aleaciones, las partículas de segunda fase tales como β-Al6(Fe, Mn) o α-Al12(Fe, Mn)3., si juegan un papel importante en el desarrollo de la microestructura.
Cada día aumenta la importancia del reciclaje, sobre todo cuando se trata de contaminantes tales como pilas alcalinas y sus residuos. Cuando estas cumplen su tiempo de vida son desechadas a la basura, y depositadas en rellenos sanitarios, éstas liberan materiales altamente tóxicos, afectando el ciclo del agua a través de la lluvia o del gas producido por la combustión. La fabricación de barías consume hasta 50 veces la energía que generan.
Reciclaje de Aluminio
Las aleaciones más importantes que se pueden elaborar utilizando aluminio secundario son Al-Si y Al-Cu destinados a la industria automotriz. Sin embargo. Otras aleaciones importantes se pueden elaborar a partir de aluminio secundario Al-Zn-Mg y las aleaciones complejas Al-Si-Cu-Mg-Zn. Las aleaciones Al-Mn no se producen a partir de aluminio secundario, sino que se obtienen mediante la fusión de aluminio primario, sin embargo, existe una buena alternativa para la obtención de estas aleaciones mediante el reciclaje de baterías alcalinas descargadas, utilizando los polvos de Mn2O3 y utilizando la técnica de reducción aluminotérmica.
Reciclaje de Baterias Alcalinas

Se han desarrollado varios estudios para el manejo de las sustancias tóxicas que se vierten en el ecosistema, con el fin de reducir y/o eliminar la contaminación del planeta. Un ejemplo claro es el tema de las pilas alcalinas, las cuales tienen un alto grado de componentes de toxicidad. Las baterías son una fuente de producción de energía eléctrica a partir de reacciones químicas, pero una vez dado de alta, son los residuos especialmente peligrosos.
Cuando una batería pierde su cubierta protectora, la exposición a la intemperie, libera metales tóxicos y materiales que se sabe que los efectos nocivos para el ecosistema y la salud de los seres humanos. Estos metales y materiales tóxicos tienen efectos nocivos sobre la salud humana que van desde lesiones graves en el hígado y lesiones del sistema nervioso central, afecciones renales, trastornos gastrointestinales, carcinoma o llegar incluso a la muerte. Las pilas alcalinas tienen una duración de tres o más veces que otro tipo de baterías.
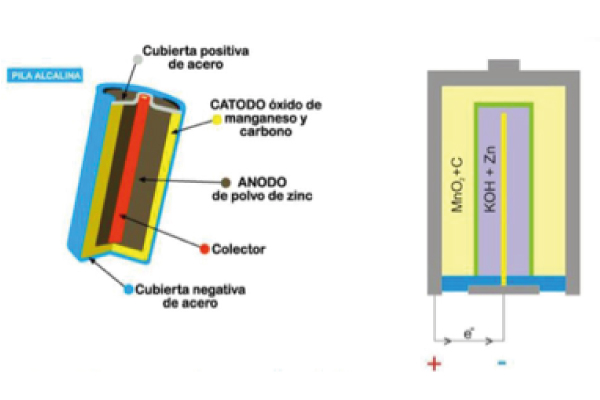


Fig. 1 Izquierda: Esquema de una pila alcalina.
Fig. 2 Centro. Apertura de pila alcalina de manganeso tamaño AA para mostrar sus elementos.
Fig. 3 Derecha. Sección longitudinal de una batería alcalina de manganeso de 9V, seis celdas conectadas en serie.
Riesgos para el medio ambiente causados por las pilas
Cuando las pilas se someten a condiciones ambientales más extremas que las que experimentan en el interior de un equipo, el blindaje está expuesto a procesos de corrosión que terminan destruyéndolo y liberando los componentes de las pilas. Se ha confirmado que por cada pila alcalina contamina 3 mil litros de agua. Por lo tanto, las pilas alcalinas descargadas deben considerarse residuos peligrosos y prohibirse que sean depositadas junto con la basura común en los rellenos sanitarios.
Las pilas alcalinas utilizan un sistema electroquímico en el que el zinc y el dióxido de manganeso son el ánodo y el cátodo, respectivamente, la reacción global en una pila alcalina está representado por:
Zn + 2MnO2 Mn2O3 + ZnO (1)
Así que los productos en el ánodo y el cátodo de una batería alcalina son ZnO y MN2O3, respectivamente. Algunos peligros identificados durante el uso de las baterías son la rotura accidental del escudo, con el derrame correspondiente de los componentes.
Diferentes tecnologías han sido desarrolladas para el manejo de este tipo de residuos, con el fin de establecer las disposiciones más apropiadas de las baterías eléctricas descargadas. Hay muchas alternativas que se pueden aplicar, entre las que destacan: la recolección, la estabilización, confinamiento, acristalamiento, ceramización y reciclado de los componentes.
El uso de materiales reciclados, tales como latas de aluminio y cátodos alcalinas como la materia prima para la fabricación de aleaciones de aluminio-manganeso por reducción metalotérmica es muy adecuado. Por lo tanto, uno de los objetivos de este estudio fue analizar la reducción del Mn2O3 y su microestructura de aleaciones de Al-Mn, producido por reducción aluminotérmica.
Reducción aluminotérmica de óxidos
El proceso metalotérmico se relaciona con la producción de metales y aleaciones por la reducción de sus óxidos. Generalmente, estas reacciones pueden ser expresadas por la ecuación:
![]() Dónde X es el oxígeno, cloro o fluoruro, A y B representan los dos metales.
Dónde X es el oxígeno, cloro o fluoruro, A y B representan los dos metales.
La principal caraterística de este proceso es que el metal al ser reducido es convertido en sólido o líquido, que se disuelve en el metal líquido. El proceso metalotérmico es usado comúnmente en acería (reducción con carbón), hidrógeno o electrolisis de una solución. La cantidad de metales usados como agentes reductores son Al, Ca y Mg.
La figura 4, muestra una representación esquemática de la reducción aluminotérmica, en el que las partículas de óxido de manganeso (Mn2O3) se reduce por el aluminio líquido en la capa límite.

Efecto del magnesio en el proceso aluminotérmico
En el proceso de reducción metalotérmica con el aluminio, el magnesio ha atraído mucha atención debido a su naturaleza tensioactiva, a que el valor de la tensión superficial de este elemento es menor en comparación con la del aluminio puro (Mg=559 dyn/cm, [Al=914 dyn/cm]). Por lo tanto, la adición de magnesio reduce la tensión superficial del baño de aluminio líquido que conduce a mejorar la humectabilidad entre el reactivo sólido y el metal líquido, incrementando así la cinética de las reacciones que tienen lugar en la interfase sólido-líquido.
Desde el punto de vista termodinámico, magnesio disuelto en el líquido tiene una afinidad por el oxígeno, como se ve por los valores de la energía de Gibbs libre de las siguientes reacciones:

La estabilidad termodinámica del óxido de magnesio (MgO) sugiere que el magnesio disuelto en el baño metálico incrementa la reactividad del proceso y, por lo tanto, la concentración del manganeso en el aluminio líquido podría incrementar. Para el caso de la reducción aluminotérmica para el trióxido de manganeso, las reacciones que toman lugar son:
 Aleaciones Al-Mn
Aleaciones Al-Mn
De acuerdo con lo anterior, es posible obtener aleaciones de Al-Mn a partir de un cátodo de una batería descargada utilizando la reacción de reducción metalotérmica con el metal líquido obtenido a partir de la fundición de latas de aluminio.
Las aleaciones de aluminio de la serie 3000 (Al-Mn) son quizás las aleaciones endurecidas más importantes. Normalmente contienen 0,25 a 1,50 % Mn, 0,05-0,2 % Cu, 0,1 % Zn y pequeños porcentajes de elementos tales como MG, Cr, Fe, Si y Ni. Debido a sus excelentes propiedades mecánicas, tienen varias aplicaciones, tales como procesamiento de alimentos, textiles y productos automotrices, artículos de cocina, recipientes a presión, elementos de construcción, paneles para refrigeradores e intercambiadores de calor.
De acuerdo con el diagrama de equilibrio de Al-Mn de la figura 5, el aluminio forma un eutéctico con la Al6Mn intermetálico a una temperatura de 658°C y una composición de 1% de Mn. La presencia de impurezas de Fe, Mg y Si es inevitable, el cambio de temperaturas da comienzo a las reacciones y a la solidificación. En primer lugar, la Al6Mn fase se sustituye por Al15(Mn, Fe)3Si2 que aparece también partículas de la fase de Mg2Si. Las temperaturas características de solidificación se reducen en cierta medida por la presencia de Si y Fe, comenzando con la formación de granos de aluminio primario a 652°C. La fase Al6(Fe, Mn) está formado alrededor de 644°C por una reacción eutéctica, la temperatura es de al menos 10°C más baja que la de una aleación de magnesio libre (3003).

Estas aleaciones tienen una dureza sólo 20% mayor que el aluminio puro. La composición química de la aleación 3004 se presenta en la Tabla 2.

Mn puede añadirse eficazmente a sólo 1,5 en peso. % (véase la figura 5). Por lo tanto, hay muy pocas aleaciones de esta serie. Sin embargo, las aleaciones 3003, 3004 y 3005 se utilizan para fabricar herramientas que necesitan dureza media y buena conformabilidad, para aplicaciones tales como latas de bebidas, utensilios de cocina, intercambiadores de calor, muebles, signos y aplicaciones arquitectónicas.
Metodología
Para obtener las aleaciones Al-Mn se requiere:
• Cátodos de baterías alcalinas
• Chatarra de aluminio (bote)
• Horno de inducción de media frecuencia
• Moldes metálicos
Resultados y discusión

Figura 7. Variación de las concentraciones de Mn y Mg, con respecto al tiempo de tratamiento, durante la reducción metalotérmica de Mn2O3, para una concentración de Mn de destino de 1 en peso. % A temperatura constante.
 Figura 8. Patrón de difracción de maestro de escoria tomada al final del experimento donde se obtuvo Al-1Mn
Figura 8. Patrón de difracción de maestro de escoria tomada al final del experimento donde se obtuvo Al-1Mn
 Figura 9. Variación de las concentraciones de Mn y Mg, con respecto al tiempo de tratamiento, duramte la reducción metalotérmica de Mn2O3, para una concentración de Mn de 1,25% a temperatura constante.
Figura 9. Variación de las concentraciones de Mn y Mg, con respecto al tiempo de tratamiento, duramte la reducción metalotérmica de Mn2O3, para una concentración de Mn de 1,25% a temperatura constante.

Figura 10. Variación de las concentraciones de Mn y Mg, con respecto al tiempo de tratamiento, durante la reducción metalotérmica de Mn2O3, para una concentración de Mn objetivo de 1,50 en peso. % A temperatura constante.

Figura 11. Tendencia en la variación de la concentración de Mn como una funcción del tiempo de tratamiento, que muestra el efecto de la temperatura.

Figura 12. Las fotomigrafías que muestran la microestructura de: a) aleación con 1% Mn; b) aleación con 1,25% Mn; c) aleación con 1,5% Mn.

Figura 13. Micrografía SEM que muestra la morfología de: a) β-Al6 (Fe, Mn): patrón de EDS de las partículas ricas en Mn, en una aleación con una concentración final d 1% Mn.
CONCLUSIONES
Es posible obtener aleaciones de Al-Mn, con concentraciones de manganeso que van 1 a 1.5%, el uso de la reducción aluminotérmica de polvos Mn2O3 producidos a partir de pilas alcalinas de cátodos. Se obtiene de metal fundido utilizando latas de aluminio que actúan como Mn2O3 reductor. Reducción aluminotérmica se lleva a cabo de manera efectiva a 800°C, lo que permite la incorporación de hasta 1.5% Mn en la aleación solidificada. La rentabilidad del proceso es de interés de beneficio, un 75% de ahorro en la compra de materias primas para la producción de aleaciones de materiales puros se podría lograr. El contenido de Mg en latas de aluminio desempeña un papel importante durante la reducción aluminotérmica, ya que tiene influencia directa sobre la capacidad de humectación de las partículas y la velocidad de reacción química.
La presencia de elementos tales con Fe y Si, influiría en el comportamiento de la aleación en solidificación, así como en el tratamiento térmico de homogeneización. La estructura de colada compuesta principalmente de partículas de la fase β-Al6(Fe, Mn), que durante el tratamiento de homogeneización se transforma en la fase blanda α-Al12(Fe, Mn)3Si, causando que la aleación se pueda deformar adecuadamente. El tipo de aleaciones obtenidas en este trabajo deben ser sometidas a un tratamiento térmico de homogeneización antes de su laminación u otros procesos de deformación. Las fases obtenidas después del tratamiento de homogeneización y los valores de las propiedades mecánicas medidas indicarían que la aleación de Al-Mn obtenida por reducción metalotérmica de Mn2O3 podría tener el mismo comportamiento en la formación de mecánica que los obtenidos a partir de elementos puros.




